プレスリリース
国立研究開発法人海洋研究開発機構
北里大学
国立大学法人福井大学
国立大学法人北海道大学
公立大学法人福岡女子大学
栄養を供給してくれる微生物を自分の細胞内に維持できるメカニズムを解明
〜深海に住む貝が何も食べずになぜ生きていける?~
1. 発表のポイント
- ◆
- 深海に生息する二枚貝シンカイヒバリガイ類は、その細胞内共生系(※1)において、食作用(※2)により共生細菌を細胞内に取り込んでいる。その際、細胞内の栄養環境シグナルを統合するタンパク質複合体mTORC1(※3)が、共生細菌の維持と消化のコントロールに関与していることを発見した。
- ◆
- mTORC1は、細胞内のさまざまなシグナルを統合して細胞の機能を調節する働きを持つことがこれまでに知られていたが、細胞内共生に関与する機能もあることが明らかになった。
- ◆
- 細胞内共生は真核生物の進化の原動力となった生命現象で、mTORC1は、昆虫などの他の動物の細胞内共生系でも細胞内共生を制御している可能性がある。本研究は生命進化や生物多様性の創出や保全に重要な知見を提供する。
【用語解説】
- ※1
- 宿主の細胞の内部に共生者が共生している関係
- ※2
- 細胞が外界に存在する微生物や異物などの粒子を細胞内の小胞(食胞)に包み込む現象。
- ※3
- mechanistic/mammalian target of rapamycin complex 1(mTORC1:エムトークワン)は細胞内の栄養やエネルギー状態を感知し、タンパク質、脂質、核酸の合成を介して細胞の成長、増殖などを制御するタンパク質複合体。
2. 概要
国立研究開発法人海洋研究開発機構(理事長 大和 裕幸、以下「JAMSTEC」という。)地球環境部門の研究グループは、海洋研究開発機構海洋機能利用部門および超先鋭研究開発部門、北里大学海洋生命科学部、福井大学医学部、北海道大学低温科学研究所、福岡女子大学と共同で、深海のメタン湧水域に生息する二枚貝シンカイヒバリガイ(Bathymodiolus japonicus)(※4)の細胞内共生系について、宿主動物が持つ細胞内の栄養環境シグナルを統合する制御タンパク質複合体であるmTORC1が、共生細菌の維持と消化を制御することを世界で初めて発見し、そのメカニズムを明らかにしました。
生物多様性保全のため、沖合海洋保護区候補地の重要海域に指定されている深海の熱水域やメタン湧水域には、二枚貝などの動物が生息しています。これらの動物の多くは、体の細胞内で化学合成細菌(※5)(共生細菌)と共生関係を結んでおり、共生細菌が作り出した有機物を栄養としてもらって生きています(図1)。しかし宿主動物が、共生細菌をどのようにして獲得・維持しているのか、どのようにして共生細菌から栄養を得ているのかについては、これまで不明で、大きな謎でした。
本研究グループでは、シンカイヒバリガイがエラ細胞の食作用によって形成された食胞の中に共生細菌を包み込んでいることを明らかにしました。また、この共生細菌を包む食胞の膜の表面に存在するmTORC1は、共生細菌から提供される有機物を検知して、共生細菌の維持と分解をコントロールしていることも初めて明らかにしました。
本成果は、mTORC1が細胞内共生系において重要な働きをしていることを示す、全く新しい証拠を示すものです。mTORC1は多くの生き物に備わっており、細胞の様々な機能を制御する司令塔の役割をしています。そのため、mTORC1の機能や細胞内共生系の成り立ちや進化を理解する上でも極めて重要な成果です。今後、細胞内共生系の制御におけるmTORC1の役割に焦点を当てて研究することで、動物と微生物の細胞内共生の成立と維持メカニズムについてより詳細に明らかになっていくものと期待されます。
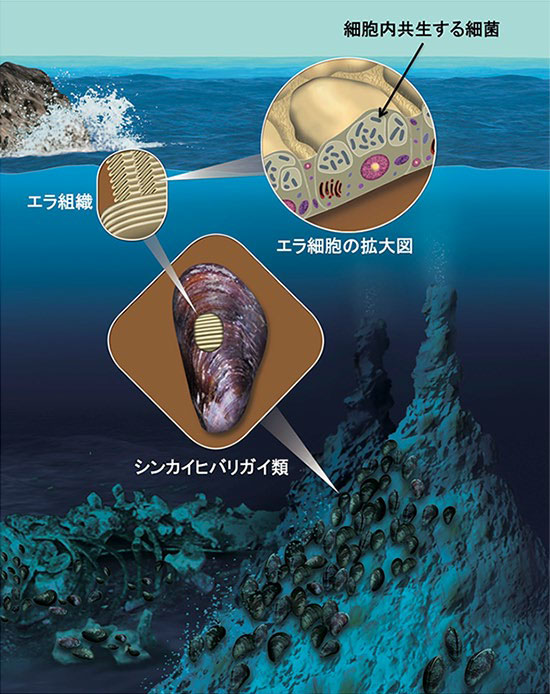
図1.シンカイヒバリガイ類の細胞内共生
シンカイヒバリガイ類の多くは、エラ組織の細胞内で化学合成細菌と共生関係を築いている。化学合成細菌は、外部の環境中から取り込まれ共生関係を築くと考えられている。(作画:吉原成行)
本成果は、「Science Advances」に8月24日付け(日本時間)で掲載される予定です。なお、研究は、日本学術振興会科研費(17K07519、20K06779、19K06799)の支援により実施されました。
- タイトル:
- mTORC1 regulates phagosome digestion of symbiotic bacteria for intracellular nutritional symbiosis in a deep-sea mussel
- 著者:
- 多米晃裕1,2,3、丸山正2、生田哲朗1、力石嘉人4、小川奈々子5、土屋正史1、瀧下清貴6、津田美和子7、平井美穂1、高木善弘7、大河内直彦5、藤倉克則1、吉田尊雄1,2
- 所属:
- 1. 海洋研究開発機構 地球環境部門、2. 北里大学 海洋生命科学部、3. 福井大学 医学部、4. 北海道大学 低温科学研究所、5. 海洋研究開発機構 海洋機能利用部門、6. 福岡女子大学、7. 海洋研究開発機構 超先鋭研究開発部門
- DOI:
- 10.1126/sciadv.adg8364
【用語解説】
- ※4
- 食用として有名なムール貝などが属するイガイ科の二枚貝。ムール貝などは、消化管がありプランクトンなどを食物として食べるが、シンカイヒバリガイ類は、口はある一方、他のイガイ類と比べると消化管が短くなっており、自ら食物を食べずに、エラ細胞内に宿す共生細菌から栄養を得ている。
- ※5
- 微生物が化学物質を酸化する際に生じるエネルギーを用いて有機物を合成する過程のことを化学合成と呼び、化学合成をおこなう細菌を化学合成細菌と呼ぶ。
3. 背景
深海の熱水域やメタン湧水域は、生物多様性保全のため沖合海洋保護区候補地の重要海域に指定されており、またレアメタルを含む鉱物・メタンハイドレートなどの有用資源が存在していることが明らかにされています。そのため、熱水域やメタン湧水域に生息する生物の生態を把握することは、資源開発と生物多様性の保全を両立するために、重要な課題となっています。
シンカイヒバリガイ類は、この海域での代表的な優占種(※6)で、生物多様性の保全や資源開発を考える上で鍵となる最重要な生物種です。シンカイヒバリガイ類は、口はあるが、近縁のイガイ類と比較すると消化管は短く、自ら食物を食べずに、細胞内に共生する共生細菌が作り出す有機物を栄養源としています。一部の昆虫やサンゴなども微生物との細胞内共生系を築いていますが、シンカイヒバリガイ類は他の共生系と比較しても、共生細菌への栄養の依存度が極めて高く、共生系の維持は自身の生存に不可欠となります。シンカイヒバリガイ類の栄養獲得様式は、共生細菌を消化して有機物を摂取するか、あるいは共生細菌から分泌された有機物をもらうかのどちらかであると考えられてきましたが、これまではっきりとした科学的証拠は得られていませんでした。また、多くの種類のシンカイヒバリガイ類は、共生細菌と「1種対1種」の共生関係にあります。これまでに、シンカヒバリガイのエラ細胞は、海水中に存在する微生物をその種類に関係なく食作用によって細胞内に取り込み、食胞の中に微生物を包み込むことが明らかにされています(Tame, et al. 2022)。また、シンカイヒバリガイは取り込んだ他の微生物を食胞の中で速やかに消化しますが、共生細菌となる特定の化学合成細菌は消化されないことも明らかにされています(Tame, et al. 2022)。しかし、環境中に数多く存在する微生物の中から、どのように特定の化学合成細菌を共生細菌として選択・獲得し、どのように細胞内で維持しているのか、その実態は謎につつまれていました。
【用語解説】
- ※6
- 生物群集で、他の種よりも個体数が特に多く、その群集の特徴を代表し決定づける種。
4. 成果
この実態を解明するため、本研究グループは、相模湾初島沖深海域(水深約900m)に生息するシンカイヒバリガイを、有人潜水調査船「しんかい6500」および無人探査機「ハイパードルフィン」・「KM-ROV」を用いて採取し、同位体比解析、遺伝子発現解析、飼育実験、顕微鏡観察を組み合わせた解析を行いました。
本研究では、シンカイヒバリガイ自身に細胞内で共生細菌の消化をコントロールするタンパク質があると予想し、遺伝子発現解析、蛍光および電子顕微鏡を用いて、食作用や消化に関わる宿主のタンパク質を探索しました。その結果、共生細菌を包み込んでいる膜は食胞膜であり、食作用における消化関連のタンパク質がその膜表面に存在することが分かりました。さらに、細胞内の栄養や環境状況を感知して、細胞の栄養環境シグナルを統合制御するタンパク質複合体であるmTORC1も同様に膜表面に存在することを明らかにしました。アミノ酸の窒素同位体組成から捕食-被食関係を推定する方法(Chikaraishi, et al. 2009)を用いて、シンカイヒバリガイと共生細菌の栄養共生関係を解析しました。共生細菌が存在するエラと共生細菌が存在しない足や外套膜では、1.1〜1.3の栄養段階を示しました。この数値は動物でありながら、一次生産を行う植物とほぼ同じ数値であり、これは、シンカイヒバリガイが、共生細菌とは捕食-被食関係にはなく、共生細菌から分泌される有機物を利用していることを示しています。一方、共生細菌のエネルギー源となるメタンを添加せずにシンカイヒバリガイを長期飼育すると、共生細菌は宿主細胞内から消失します(図2)。長期飼育したシンカイヒバリガイのエラ、足、外套膜の栄養段階は1.9となり、共生細菌を消化して栄養を得たことを示す値となります。実際に、メタンを添加せずにシンカイヒバリガイを長期飼育すると、mTORC1が存在している食胞内の共生細菌は消化酵素により分解されます(図2と3)。ところが、mTORC1の阻害剤を添加して飼育した場合には、共生細菌は消化されずに維持されていることを発見しました(図3)。
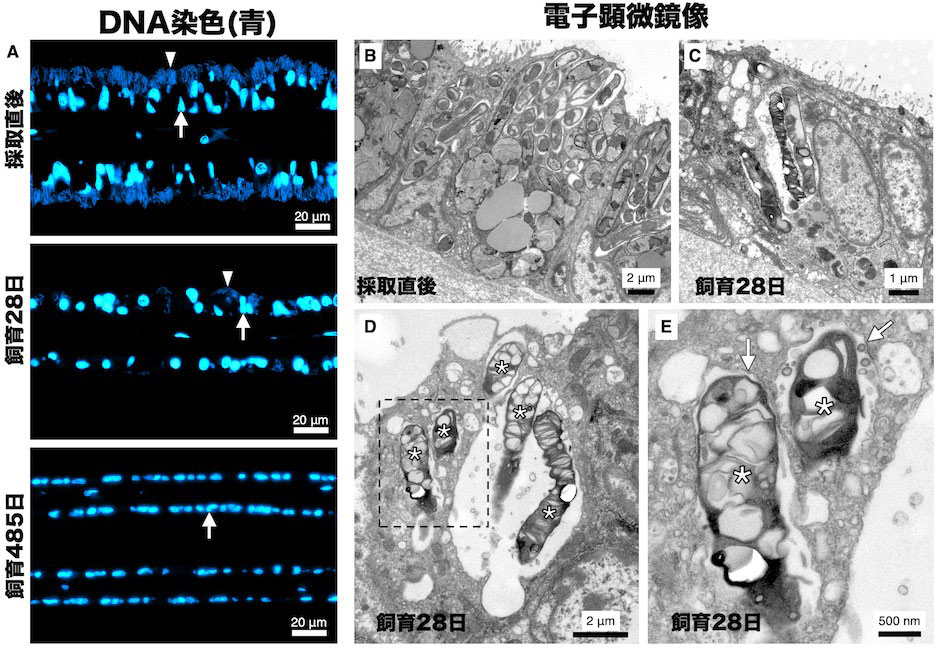
図2.シンカイヒバリガイの長期飼育による共生細菌の消失
共生細菌のエネルギー源となるメタン添加なしで飼育したシンカイヒバリガイのエラ内部の蛍光顕微鏡像と電子顕微鏡像。(A)DNAの蛍光染色剤DAPIで染色した青色のシグナルの蛍光顕微鏡像。矢印は宿主の核を示し、矢尻は共生細菌を示している。飼育28日では採取直後よりも共生細菌が減り、飼育485日には、共生細菌は消滅している。(B-E)透過型電子顕微鏡像。(B)飼育前の採取直後のエラ。細長い棒状の形をした共生細菌が見られる。(C-E)飼育28日のエラの像。(E)は(D)の点線枠部分を拡大した像。アスタリスクは、共生細菌の内部の構造が不明確になっている共生細菌を示している。
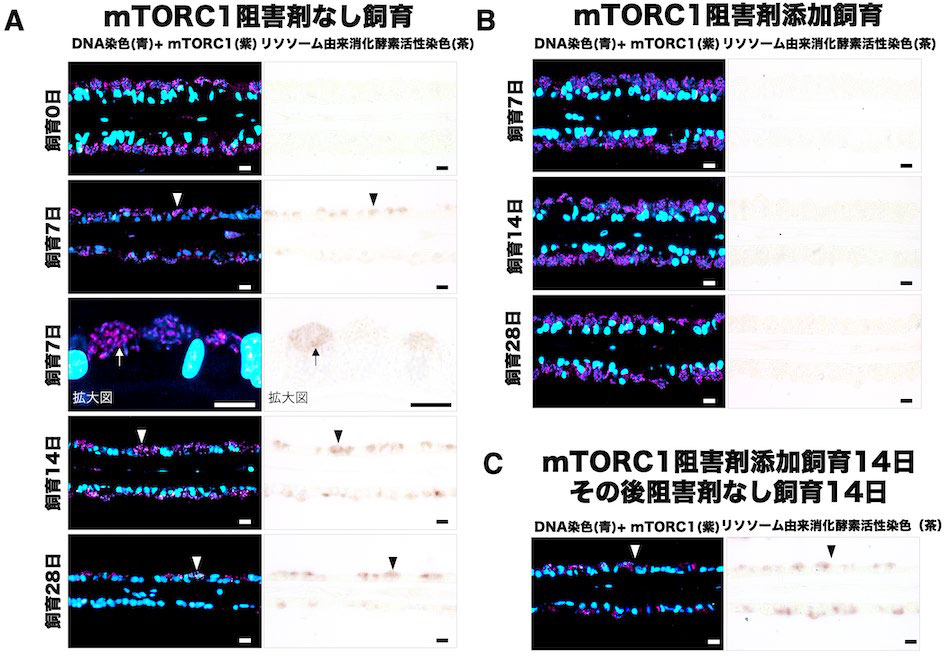
図3.mTORC1阻害剤添加飼育により共生細菌の分解を抑える
mTORC1阻害剤の有無で飼育したシンカイヒバリガイのエラ内部におけるmTORC1の存在を示した蛍光顕微鏡像(青色シグナル:DAPIによるDNAの蛍光染色、紫色シグナル:mTORC1抗体を用いた蛍光免疫染色)と消化酵素活性染色した光学顕微鏡像(茶色シグナル:酵素活性を検出)。(A)mTORC1阻害剤なしで飼育したシンカイヒバリガイのエラの像。飼育日数が増えると酵素活性が検出されると共に、共生細菌が減少している。(B)mTORC1阻害剤ありで飼育したシンカイヒバリガイのエラの像。飼育日数が増えても、消化酵素活性は検出されず、共生細菌は維持された。(C)mTORC1阻害剤あり14日間で飼育した後に、mTORC1阻害剤なしで飼育したシンカイヒバリガイのエラの像。消化酵素活性が検出され、共生細菌は減少している。
mTORC1は真核生物が普遍的にもつタンパク質複合体で、細胞内の栄養状態を見張って細胞の様々な機能を制御する司令塔の役割が注目されるタンパク質です。例えば、生物は栄養状態に応じて、細胞分裂を活発に行ったり、個体サイズを大きくしたりします。がん細胞は、栄養状態を顧みずにどんどん増殖してしまう細胞で、この制御にもmTORC1が深く関与していると考えられています。また、細胞内の不要な物質を分解消化するオートファジーや老化・寿命にもmTORC1が関与していると考えられています。これまでの研究(Tame, et al. 2022)と本研究結果をあわせて考えると、シンカイヒバリガイは、エラ細胞の食作用により環境中の微生物を選択することなく十把一絡げに細胞内に取り込み、共生細菌以外の微生物を速やかに消化しています。一方、食胞の中の共生細菌に関しては、分泌されるアミノ酸などの有機物をmTORC1により検知することで、維持するのか、あるいは消化分解するのかを選択していることが分かりました。本研究では、真核生物が普遍的に持つ細胞内の栄養環境シグナルセンサーとして働くmTORC1が細胞内共生の選択と維持に関与するという新しい知見を得ることができ、mTORC1が細胞内共生系において重要な働きをしていることが初めて証明されました(図4)。
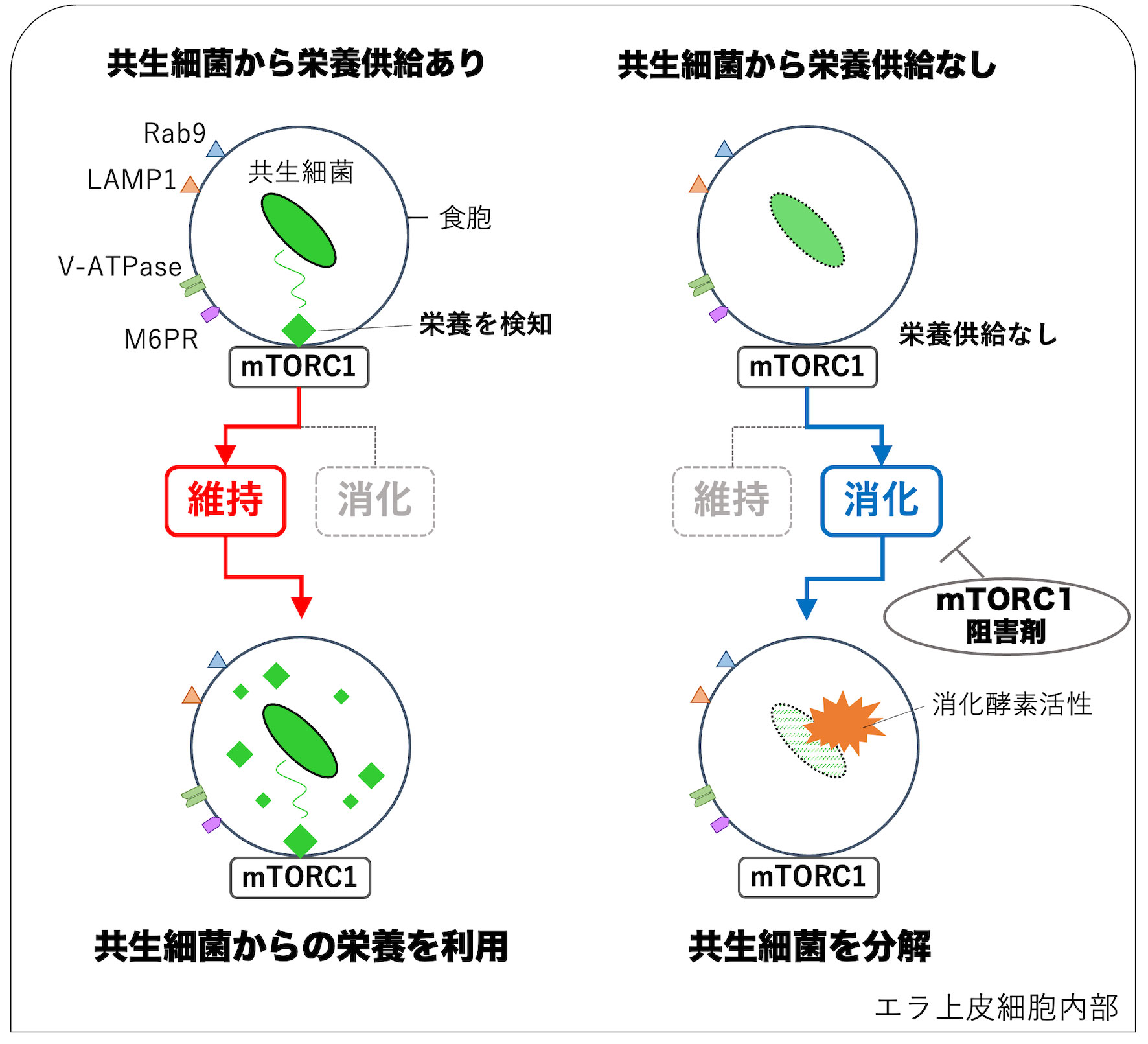
図4.シンカイヒバリガイ細胞内共生系におけるmTORC1を介した共生細菌の維持と分解の制御機構
シンカイヒバリガイのエラ細胞は食作用により共生細菌は食胞の中に包み込まれます。この食胞には、食作用および消化関連タンパク質(Rab9,LAMP1,V- type ATPase(V-ATPase), マンノース6-リン酸受容体(M6PR))とともにmTORC1が存在します。共生細菌から栄養となる有機物が分泌されている場合には、共生細菌を維持し、共生細菌からの栄養を用いてタンパク質や核酸や多糖類などを合成しています。共生細菌からの栄養供給が減少すると、mTORC1 は消化酵素によって共生細菌を消化分解することでアミノ酸、ヌクレオチド、単糖などの栄養を得ます。この消化のプロセスはmTORC1阻害剤によって阻害されました。
5. 今後の展望
今回の成果は、真核生物の細胞内の栄養シグナル統合制御において司令塔として働くmTORC1 が、細胞内共生系において共生細菌の維持と分解に関与するという新しい機能を明らかにしました。細胞内共生は、地球の生命史において、真核生物の進化の原動力となった現象で、今現在でも地球上のいたるところで見られる現象です。昆虫などの他の動物の細胞内共生系でもmTORC1が重要な役割を果たしている可能性が考えられるため、本研究の成果は、細胞内共生系の成り立ちや維持機構を考える上で、新たに明らかになった重要な知見です。これは、生物多様性の保全を考える上でも最重要の基礎的知見になる可能性があります。
今後は、共生細菌がどのような有機物を作り出しシンカイヒバリガイに供給しているか、供給される有機物の何をmTORC1が検知して、共生細菌の維持を行うのかなど、詳細な研究を実施することで、細胞内共生の成立と維持メカニズムがより明らかになっていくものと期待されます。
引用文献A. Tame, T. Maruyama, T. Yoshida, Phagocytosis of exogenous bacteria by gill epithelial cells in the deep-sea symbiotic mussel Bathymodiolus japonicus. R. Soc. Open. Sci. 9, 211384 (2022).
Y. Chikaraishi, N. O. Ogawa, Y. Kashiyama, Y. Takano, H. Suga, A. Tomitani, H. Miyashita, H. Kitazato, N. Ohkouchi, Determination of aquatic food-web structure based on compound-specific nitrogen isotopic composition of amino acids. Limnol. Oceanogr Method. 7, 740–750 (2009).
- (本研究について)
- 国立研究開発法人海洋研究開発機構
- 地球環境部門海洋生物環境影響研究センター深海生物多様性研究グループ
- 主任研究員 吉田尊雄
- 国立大学法人福井大学
- 医学部
- 技術職員 多米晃裕
- 国立大学法人北海道大学
- 低温科学研究所
- 教授 力石嘉人
- 公立大学法人福岡女子大学
- 国際文理学部 環境科学科
- 教授 瀧下清貴
- (報道担当)
- 国立研究開発法人海洋研究開発機構 海洋科学技術戦略部 報道室
- 学校法人北里研究所 総務部広報課
- 国立大学法人北海道大学 社会共創部広報課
- 公立大学法人福岡女子大学 戦略企画センター