研究内容紹介
「タンパク質の構造解析からエネルギー通貨の進化の痕跡を探る」
―「ピロリン酸は原始的なエネルギー通貨だった説」をサポートする証拠を発見―
千葉 洋子 外来研究員
(元 JAMSTEC Young Research Fellow)
紹介を始める前に、、、
前回の張 研究員の長大作に続き、今回の「研究内容紹介シリーズ 」は、なんとっ!!珍しく?自ら率先して寄稿を申し出てくれたとっても尊い研究紹介です。 細胞内のお金の話!?エネルギー通貨って何?電子マネー?と思われた方は、ぜひペイペイっと最後まで一気に読んでみてください。はじめに-「生命とは負のエントロピーを食うものである (Schrödinger) *1」
「生命をもたないものは、放っておけば必ず無秩序状態に陥る。ビルは崩壊し、死骸は朽ちる。これに対し生きている細胞は、蝶や花という大きなスケールの構造から、生物を構成する分子の中の原子の組織化にいたるまであらゆるレベルで、秩序を維持し、さらに秩序を生み出す。生命のこの性質は、細胞のもつ見事な機構に支えられている。
細胞は環境からエネルギーを取り出して利用しやすい形に変え、それを用いて生物特有の秩序を作り続けている。」
(1999年 南江堂 Essential 細胞生物学 P. 79より引用)
これは私が大学1回生*2 のときに購入した細胞生物学の教科書の1節です。高校の教科書と比較して大きくて分厚いし、すごく高い(8000円)!! 一方で、生物の本質を突いている美しい文章だなぁと感じ、大学で学ぶことにわくわくした記憶があります(なんて書くとめちゃくちゃ優秀な学生だったと思われそうですが、実際には残念ながらそうでもなかったです。確か某関連授業で追試を受けたような。。)で、教科書には上記の文章に続き、2枚の写真が並んでいます。きれいに片づけられた子供部屋とめちゃめちゃになった同じ部屋―「日常に見られる、無秩序状態への自発的過程。無秩序へと向かう傾向を逆転させるには、意識的な努力とエネルギーの投入が必要であり、これは自発的には進まない。(以下略)」と説明されています。私、片付けが苦手なのですごくわかります。部屋を整頓された状態で保つには精神的・肉体的エネルギーが不可欠ですよね。。
生命のエネルギー通貨-ATPの原型は?
前置きが長くなりました。私は生命に不可欠な代謝、そしてその代謝に必要なエネルギーの進化に興味をもっています。生物が外界から取込むエネルギーの形態には、いろいろなものがあります。太陽光、我々が食べるごはん(有機物)、深海熱水孔で湧き出す水素などの無機物、電気(詳しくは山本研究員の研究紹介参照)がこれまでに知られています。一方、外界から取込んだこれらエネルギーは利用しやすい形、すなわちアデノシン三リン酸(ATP)という化合物に変換してから使われます。このように細胞外から取込むエネルギーの形態には生物種によって多様性があるのに対し、ATPに変換してから様々な代謝反応に使う、という部分はこれまでに知られている現存生物全てに共通です。そのため、ATPは「エネルギーの共通通貨」と呼ばれています。水力、火力、原子力などなど発電方法はいろいろあるけれど、我々の家庭に送られてくるエネルギーは電力に統一されているのと似ていますね。
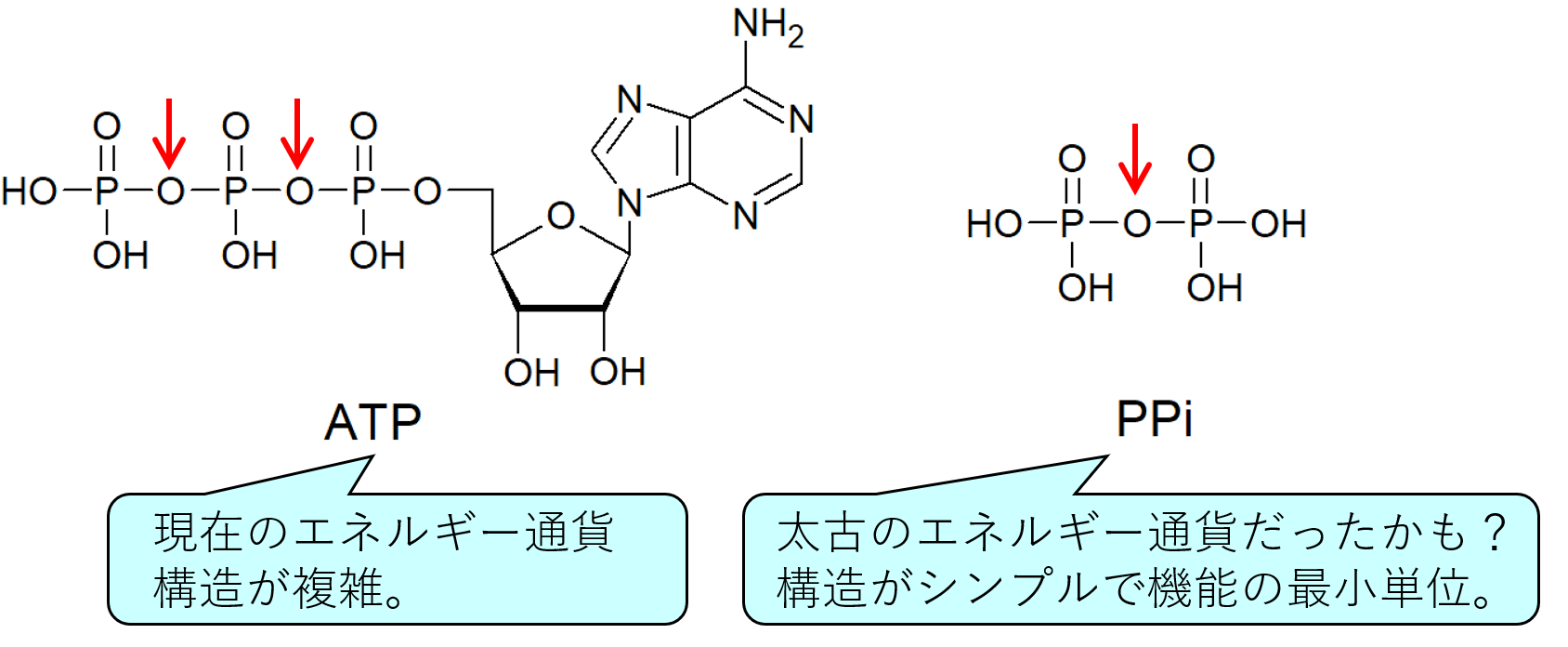
図1 ATPとPPiの構造比較
赤矢印の部分の結合が切断されると、大きなエネルギーが得られます。
PPi: ピロリン酸(無機二リン酸)
上の図1に、ATPの構造を記しました。ATPはリン酸—リン酸間の結合を切るときに大きなエネルギーを生むことができるので、エネルギーを蓄えられられる、すなわちエネルギー通貨として働くことができます。しかし、勘のいいあなたは思うのではないでしょうか?リン酸-リン酸結合が重要であるならば、残りの複雑な構造はいらなくない?そうですよね。現在の生物内ではこの複雑な構造が大切な仕事をしているのですが(本件について、今回は割愛させていただきます。)、今のような洗練されたATP合成システムをおそらく持っていなかった原始的な生物が、エネルギー通貨としてATPを使っていたとは考えにくいです。そこで出てくるのが今回注目する分子、ピロリン酸(無機二リン酸、PPi)です。上の図1のようにPPiはリン酸が2分子つながった分子で、ATPと同様に切断すると大きなエネルギーを生むことができます。PPiはエネルギー通貨として必要な最低限の構造からなることから、原始のエネルギー通貨だったのでは、と昔から考えられてきました。
もしPPiが原始のエネルギー通貨であったのであれば、その痕跡を探したい!と少なくない研究者が考えました。実際、現存するいくつかの生物はATPの代わりにPPiをエネルギー源として利用する酵素(=代謝反応を促進させる触媒タンパク質)を持っています。そのため、これらPPi利用型酵素はATP利用型酵素の原型だったのではないか!?と期待され、それを証明すべく実験が行われました。具体的に言うと、同じ反応をPPiのエネルギーを使って触媒する酵素と、ATPのエネルギーを使って触媒する酵素のアミノ酸配列を比較して、その近縁関係や進化の道筋が調べられました。しかし、そこから導き出された答えは、期待された結果と逆でした。PPi利用型酵素はATP利用型酵素から進化したものと考えるのが合理的だったのです(図2A)。そんなわけで、「PPiは原始のエネルギー通貨だった説」は2000年代前半以降、下火になっていました。
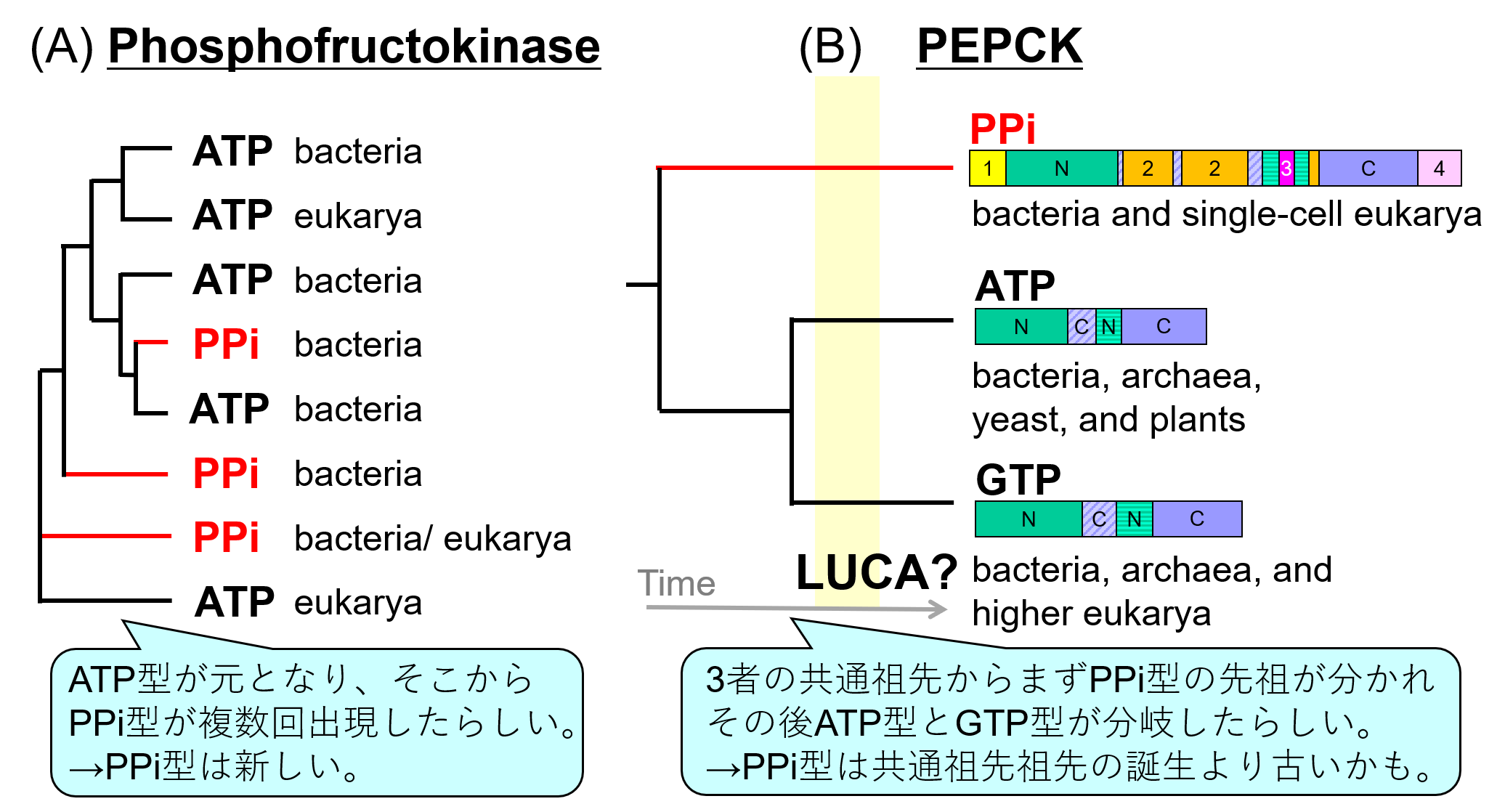
図2 同じ機能を有するATP型酵素とPPi型酵素の進化的関係の比較
(A) これまでに一番よく調べられていたphosphofructokinaseの例。Baptesteらの論文*3 の図を改変。
(B) 今回研究したPEPCKの進化的関係。
新しいPPi型酵素の発見は新たな風を吹き込むか?
さて、今から5年ほど前に私は新しいPPi利用酵素(PPi型phosphoenolpyruvate carboxykinase, PPi-PEPCK)を発見しました*4。PEPCKにはPPiを利用するものの他に、ATPを利用するもの、またATPとよく似ている分子であるGTPを使うものが知られています。しかし、PPi-PEPCKのアミノ酸配列はそのどちらにも似ておらず、類縁関係がないように思われました。一方で、ATP-PEPCKとGTP-PEPCKはアミノ酸配列こそ似ていないものの、それらが折りたたまれてできるタンパク質の立体構造はよく似ていることが知られています。ではPPi-PEPCKの立体構造はどうなのでしょうか?そこで我々JAMSTECと東京大学のチームは世界で初めてPPi-PEPCKのX線結晶構造解析を行いました。(さて、次章からやっと論文紹介が始まります。)
新規PPi 型酵素の構造解析
何年間にもおよぶ地道な努力の末にPPi-PEPCKの構造を明らかにしたところ(図3AB)、本構造はATP-PEPCKおよびGTP-PEPCKととてもよく似ていることが分かりました(図3C)。ただしPPi-PEPCKは他の2種類の2倍くらい大きくて、ATP-PEPCK、GTP-PEPCKと構造を共にする「N-domainおよびC-domain(=コア構造)」に加えて、PPi-PEPCK独自の「付加構造1-4」を持っていました。また、単に構造が似ているだけではなく、コア構造を作るパーツの順番がアミノ酸配列上で完全に一致していたこと、さらに反応を触媒するメカニズムが一致していることも分かりました。これらの結果から、3種類のPEPCKの構造は偶然一致したのではなく、これらが共通の祖先を有していると考えるのがリーズナブルであること言えます。すなわち、アミノ酸配列からは気づくことができないくらい遠く離れた類縁関係を、本立体構造解析によって初めて明らかにすることができました(図2B)。また、3種類のPEPCKの構造の比較から、PPi-PEPCKがPPiをエネルギー通貨として認識するのには、付加領域の存在が役立っていることも示唆されました。

図3 PPi-PEPCKの構造
(A) PPi-PEPCKの3次元構造。N-domainとC-domainからなるコア構造に加えて、付加構造1-4を有する。(B) PPi-PEPCKの1次構造。付加構造2と3はそれぞれC-domain、N-domainの間に挿入されている。(C) PPi-PEPCKとATP-PEPCKおよびGTP-PEPCKの構造比較
さて、3種類のPEPCKに類縁関係があることは分かりましたが、PPi-PEPCKはATP-PEPCKおよびGTP-PEPCKより古いのでしょうか?残念ながら現在の知見からはこれについて結論は出せません。ただし、以下のことは言えます。
- 3種類のPEPCKの共通祖先からまずPPi-PEPCKの祖先*5が分かれ、その後にATP-PEPCKとGTP-PEPCKの祖先が袂を分かった。
- ATP-PEPCKの祖先とGTP-PEPCKの祖先が袂を分かったのは、現存生物の共通先祖(last universal common ancestor, LUCA)の誕生よりおそらく昔のことである。
要約すると、PPi-PEPCKの構造解析によって、PPiが太古の生物においてエネルギー源として使われていた可能性が高まりました。PPiがATP以前のエネルギー通貨であったかどうかは今回の研究からのみではわかりませんが、今後様々なアプローチ方法による研究成果が蓄積することで、エネルギー代謝・エネルギー通貨の進化について理解が深まることを期待しています。
- *1 Erwin Schrödinger. What is life? The physical aspect of the living cell and mind. Cambridge. Cambridge University Press. 1944.
- *2 関西の大学では「年生」ではなくて「回生」を使うのがマジョリティのようです。
- *3 Eric Bapteste, David Moreira, and Hervé Philippe. Rampant horizontal gene transfer and phospho-donor change in the evolution of the phosphofructokinase. Gene 2003; 318: 185-191.
- *4 Yoko Chiba, Ryoma Kamikawa, Kumiko Nakada-Tsukui, Yumiko Saito-Nakano, Tomoyoshi Nozaki. Discovery of PPi-type phosphoenolpyruvate carboxykinase genes in eukaryotes and bacteria. J. Biol. Chem. 2015; 290: 23960-23970
- *5 PPi-PEPCKの祖先、というのは現存するPPi-PEPCKの元となったタンパク質のことです。この祖先タンパク質が現在のPPi-PEPCKのように既にPPiのみをエネルギー源として使用していたのか、それともATP, GTP, PPi全てをエネルギー源として使用可能であったのか、はたまたATPまたは他の物質のみを使用していたのかは今のところ分かりません。PPi-PEPCKの祖先が現在のPPi-PEPCKのようにPPi のみを使用するように進化したタイミングを明らかにするためには、さらなる研究が待たれます。
J. Biol. Chem. 2019; Vol:294, 19269-19278. © Chiba and Miyakawa et al.
JBCオープンアクセス版は こちら
ページ先頭へ戻る
研究内容紹介を読んでみて Q&A
★高井P長:
ピロリン酸(PPi)は自然環境に豊富に存在している?40億年前の地球にもあったのでしょうか?
-
実際にあったのかは私にはわかりませんが、生命が誕生する前(~40億年前)の深海熱水孔を模した環境でPPiが作られることを確認した研究はあります。ただし本研究でPPiは沈殿物として検出されています。大半が不溶化していても一部可溶化すれば使用可能で、使用されれば平衡が傾いてさらに溶けた状態のPPiが供給されるのではないかと考えているのですが、どうなんでしょう?(ご存知の方、教えていただけませんか?)
★高井P長:
ポリリン酸をエネルギー通貨に使う酵素はあるの?
-
レアではありますが、あります。polyphosphate-glucose phosphotransferase (EC 2.7.1.63)は短いポリリン酸(炭素鎖長30くらい)から長いポリリン酸(鎖長500以上)まで使えます。ちなみに本酵素はPPi-PEPCKと異なりポリリン酸に加えてATPもエネルギー通貨として使えるそうです。他にもポリリン酸を使える酵素があるかメジャーな酵素データベースで調べてみたのですが、ざっと見た限りはなさそうです。
(編集者注釈: EC番号(酵素番号とは))
★高井P長:
この研究は、アミノ酸配列だけでの進化系統だけではホントーの進化はみえないかもしれない。機能は構造に宿る。ちゅうことで構造が重要なんや!と言うことだと思うのですが、そうですよねぇ?
-
・・・!!(文章からエネルギーを感じてひるみました。)
そうですね、短期間の進化であればアミノ酸配列だけからでもそれなりに信頼できる進化系統情報が得られると思うのですが、今回のようにアミノ酸配列ベースで類縁関係に気づけない(=系統樹を描くのが難しい)くらい配列に変異が蓄積した長期間(例えば現在~LUCAの誕生以前)の進化を明らかにするには、タンパク質の立体構造が非常に役立つと思います。既にタンパク質の立体構造が似ているものを簡単(BLAST searchみたいな感じ)に検索可能なシステムが存在します。ですので、もしも遺伝子配列を読むのと同じくらい手軽に(例えば結晶化しなくていいとか)タンパク質の立体構造情報を得られるようになったら、タンパク質の進化や機能未知タンパク質の機能に対する理解は飛躍的に深まるのではないかと思います。
(編集者注釈: BLASTとは)
★高井P長:
タンパク質の結晶構造屋さんって昔は変人が多かったのですけど最近は立派な人も多いのでしょうか?
-
う~ん、高井さんの中での変人と立派な人のイメージが分からないのですが、高井さんご自身は変人ですか?立派な人ですか?そもそも変人と立派な人は対義語なのでしょうか??立派な変人=魅力的な人だと思うのは私だけでしょうか???
★通りすがりの玄人A:
ピロリン酸(PPi)は、色々な陽イオンと結合して沈殿が生じやすいから、水を必須とする地球生命体にとってはかなり不都合なのでは?
PPiを使うことは進化的に不利だと言って良いでしょうか?
そういった意味で、PPi-PEPCKは、なぜ進化の過程で消えていないでしょうか?ATPでなく、わざわざPPi(のみ)を使うメリットは何ですか?
-
沈殿しやすさという観点でPPiよりATPの方が優れている、という視点は私にかけていました。コメントありがとうございます!細胞内に溶けた状態で高濃度に蓄積できる分子の方が、エネルギー通貨として優れていると思います。
生物にとってPPiを使うメリットは、エネルギーを効率的に利用できることにあると思います。実は現存生物にとってPPiはタンパク質を作る、DNAを複製するといった根源的な反応を含む200以上の反応で生じる副産物なのです。つまり、ATPはエネルギーを投入して意図的に作らなくてはならないものであるのに対して、PPiは生物活動(代謝)の結果生じるゴミみたいなものです。細胞内にPPiが蓄積することは生物にとって致命的で、ほぼすべての生物はPPi分解酵素を持っています。この酵素はPPiをリン酸に分解する反応を触媒し、この時PPiのエネルギーは熱として失われてしまいます。したがって、細胞内の一部の反応でATPの代わりにPPiを使えれば、1杯のごはんから取り出せる正味の化学エネルギー量が増えるわけです。そのためか、現在PPi利用酵素を持っている生物は、ATP産生効率の低い無酸素・低酸素環境に生息しているものが多いです。
まとめると、PPi-PEPCKのようにPPiのみを使う酵素が生き残れた理由としては、限られたエネルギーを効率的に使用したいという需要があったから、が考えられると思います。
★読者B:
タンパク質は退化する事ってありますか?進化する一方ですか?
-
退化というのはネガティブな変化という意味ですよね?個人的には、経時的な変化=「進化」と理解しているので、その変化がポジティブであってもネガティブであっても中立であっても「進化」ととらえています。また、ある変化が本当にネガティブorポジティブか判断するにはたくさんのパラメーターを考慮する必要があり、限定した枠内でない限り判断するのは難しいと思います。退化することはありうるけれど、本当にそれが退化なのかは神のみぞ知る、というのは答えになっていますでしょうか?
★読者B:
一つの生物が持っているPEPCKは、
PPiかATPかGTPのどれかの型に限られるのですか?
全部の型を持っているヤツや、どれか1つしか持っていないヤツが居たりするのですか?全部持ってる場合の使い分けってどうなってるんですか?
エネルギー効率の良いATPから先に使うんでしょうか?
-
興味深いことにPPi-PEPCKを持っている生物の多くがATP-PEPCKもしくはGTP-PEPCKも持っています。使い分けについてはまだ全く分かっておらず、私としてもとても興味があります。ATPの方がエネルギー効率がよいかどうかは、どれだけ潤沢にATPを産生できるかなど細胞の条件によるのではないかと思います。
ページ先頭へ戻る
